1970年代に細胞を大量培養できる担体が開発されたことに端を発し、その後、特に再生医療の実現化に欠かせない技術として発展してきた三次元培養法。『BioGARAGE』では2012年9月にこの培養技術の紹介を行っているが、その後も新しい手法や測定法、分野の広がりなど発展が目覚ましい。そこで今回は、最も新しい三次元培養法のひとつである技術の紹介と、三次元培養法を用いて何をするのかという部分に焦点を当て、技術や研究の紹介を行っていく。
現在、多様な手法での三次元培養が可能になり、自身の研究に合わせて選択することができる。 そこでまずは、市場に出ている各社の技術を俯瞰してみよう(下表)。
| 培養法の分類 | 製品名(または材料名) | 社名 | ||
| スキャフォールド型 | ハイドロゲル | 動物由来 | Matrigel® | コーニング、BD 他 |
| コラーゲン | 新田ゼラチン、ニッピ、高研 他 | |||
| 植物由来 | アルギン酸ハイドロゲル | PGリサーチ | ||
| 合成化合物 | QGelTM MT 3D Matrix | Qgel SA | ||
| 3-D Life Biomimetic Hydrogels | Cellendes | |||
| PuramatrixTM | 3D MATRIX | |||
| 多孔性三次元培養 プラットフォーム |
alvetex | reinnavate | ||
| 3D InsertTM | 3D Biotek | |||
| VECELL® Insert | ベセル | |||
| スキャフォールド フリー型 | 低接着プレート | PrimeSurface® | 住友ベークライト | |
| Ultra-Low Attachment | コーニング | |||
| NunclonTM SpheraTM | サーモサイエンティフィック | |||
| マイクロパターン表面 プレート |
NanoCulturePlate® | SCIVAX | ||
| Cell-ableTM System | トランスバレント | |||
| CYTOO Adhesive Micropatterns | CYTOO | |||
| ElplasiaTM Microspace | クラレ | |||
| CytoCapture Dish | zell-kontakt | |||
| ナノピラープレート | 日立ハイテクノロジーズ | |||
| ハンギングドロップ法 | GravityTRAPTMプレート | InSphero | ||
スキャフォールド型
動物由来のハイドロゲル
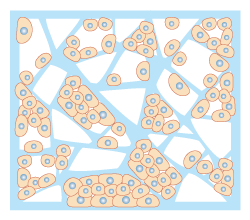
図1 多孔性担体での培養
ゲルや不織布内部に張り巡らされた足場を利用し、細胞が立体的に増殖していく。
利点
- 使用実績が多い
- 動物由来なので、細胞のインテグリンに結合するリガンドが含まれている可能性が高い
- 細胞の生存率や増殖を高める因子が含まれている可能性が高い
- 市販品の種類が豊富
短所
- 動物由来の増殖因子などが含まれている場合、実験に影響を及ぼす可能性がある
- ロット間にばらつきがある場合がある
植物由来のハイドロゲル(アルギン酸ハイドロゲル)
カルシウム存在下でゲル化しキレート剤を添加することで溶液になるという、アルギン酸の性質を応用している。液体の状態で細胞懸濁液を調整し、その後ゲル化させて培養、再び液化して細胞塊を回収することが可能。
利点
- ゲル化と液化を制御することが可能
- 動物性タンパク質による悪影響がない
- 細胞を回収することが容易
短所
- 人工基質であるため、細胞生存率や増殖を高める因子は含まれない
合成化合物のハイドロゲル
ロット間の差が少なく、細胞種を選ばず使用できることが特徴。
利点
- ロット間の差が少ない
- 動物性タンパク質による悪影響がない
- インテグリンやRGDペプチド(細胞接着を促進することが知られている)で修飾することも可能
- ゲルの硬さの制御も可能
短所
- 人工基質であるため、細胞生存率や増殖を高める因子は含まれない
多孔性三次元培養プラットフォーム
細胞培養用プレートのウェルに多孔質ポリスチレン製ディスクなどを入れ、その空洞で細胞が増殖する。
利点
- 小さいスケール(96, 384 well plate)でも使用可能
スキャフォールドフリー型
短所
- 顕微鏡で培養中の細胞を観察することができない
- 適用外のアッセイがある
スキャフォールドフリー型
低接着プレート
親水性ポリマーでコーティングし接着を抑えて培養することで、細胞自身が作る細胞外マトリックスによって互いに接着し増殖する。平底の場合はマルチスフェロイドが形成され、U底やV底の場合はシングルスフェロイドが形成される。
利点
- 384well plateにも対応可能で、ハイスループット化しやすい
- シングルスフェロイドとマルチスフェロイドを選択可能
- フラスコで大量に培養することも可能
短所
- 平底では、スフェロイドは均一のサイズにならない
- フラスコでの培養はサイズを選択することができない
マイクロパターン表面プレート
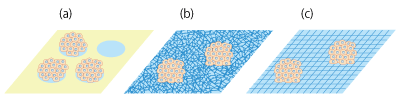
図2 プレート上でのスフェロイド形成
(a)細胞がディッシュ底面の非接着性表面(黄色)を避け、接着性表面(水色)のみに集積する。(b)(c)ナノファイバーあるいはナノサイズの格子を敷き詰めることで、細胞の接着を抑制して広がりを抑え、スフェロイドを形成させる。
利点
- ウェルに複数のスフェロイドができる
- サイズを制御したスフェロイド形成が可能な場合がある短所
- 培地交換によりスフェロイドを損失してしまう可能性あり
ハンギングドロップ法
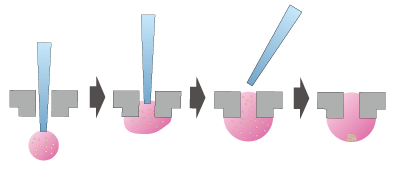
図3 液滴中でのスフェロイド形成
ディッシュにあいた穴にチップを通し、チップ先端に細胞入り培地ドロップを作る。そのままチップを引き抜くとドロップがディッシュの穴に留まり、細胞は重力に従ってドロップの底で凝集する。
利点
- シングルスフェロイドになる
- ハイスループット化しやすい
- スフェロイドのサイズを制御しやすい
- 大きなスフェロイドで低酸素状態を模倣することが可能
短所
- MTTアッセイなどには細胞数が少なすぎるため適用外
ここまで、現在の三次元培養技術を俯瞰してきた。形成するスフェロイド(細胞擬集塊)のサイズやそれに伴う酸素や栄養の浸透程度、また構成する細胞集団の不均一性などを考慮しながら、研究内容に合わせた手法を選択することが重要である。これまでに開発されてきた細胞のアッセイは多くが単層培養か浮遊培養の細胞を対象としたものなので、三次元培養の細胞に対し目的のアッセイが適用可能かどうかを検証する必要がある。
この細胞培養法の特徴は、単層での培養よりも組織の構造により近いため、組織の細胞に模倣した細胞機能を発揮できる可能性が高いことなどが挙げられる。そのため再生医療、創薬、医薬品や化粧品などの安全性試験など、この技術は複数の分野で活用され、研究を新しい段階へと推し進める原動力となっている。
(参考)
Terry Riss,Overview of 3D Cell Culture Model Systems & Validating Cell-based Assays for Use with 3D Cultures(2014)
https://www.promega.jp/resources/webinars/worldwide/archive/overview-of-3d-cell-culture-model-systems/